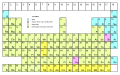
Układ okresowy pierwiastków
Układ okresowy pierwiastków (potocznie: tablica Mendelejewa) – zestawienie w postaci tabeli wszystkich pierwiastków chemicznych, uporządkowanych według ich rosnącej liczby atomowej, grupujące pierwiastki według ich cyklicznie powtarzających się podobieństw właściwości, zgodnie z prawem okresowości Dmitrija Mendelejewa[1].
Użyteczność układu okresowego wynika z faktu, że w prostej formie przedstawia on zależność właściwości chemicznych pierwiastków i pośrednio także ich prostych związków chemicznych od liczby występujących w nich protonów i elektronów. Współczesna, oficjalna wersja układu okresowego, publikowana cyklicznie przez Międzynarodową Unię Chemii Czystej i Stosowanej (IUPAC), definiuje też podział pierwiastków na grupy, okresy i bloki. Wersja układu okresowego opublikowana przez IUPAC 28 listopada 2016 roku zawiera 118 pierwiastków o liczbach atomowych od 1 do 118[2]. Odkrycia pierwiastków o liczbach atomowych 113 (nihon), 115 (moskow), 117 (tenes) i 118 (oganeson) zostały potwierdzone w grudniu 2015 roku, a oficjalnie nazwy tym pierwiastkom nadano w listopadzie 2016 roku[3][4].
Sens fizyczny układu okresowego[edytuj | edytuj kod]

Prawo okresowości Mendelejewa, stanowiące podstawę teoretyczną układu, wynika z faktu, że liczba atomowa określa nie tylko liczbę protonów, występujących w jądrze atomów, ale też liczbę elektronów atomów w stanie obojętnym, która ma decydujący wpływ na ich właściwości chemiczne.
Elektrony w atomach są umiejscowione na kolejnych powłokach, które mają określoną pojemność, czyli maksymalną liczbę elektronów, jaka może się zmieścić na powłoce. Kolejne powłoki są zajmowane przez elektrony dopiero po całkowitym zapełnieniu powłok leżących poniżej (o mniejszej energii). Zjawisko „zapełniania” powłok wynika z zakazu Pauliego, który w stosunku do atomów stwierdza, że na jednym orbitalu mogą znajdować się najwyżej dwa elektrony różniące się spinem. Elektrony na ostatniej, najbardziej zewnętrznej powłoce, nazywanej powłoką walencyjną, są najsłabiej związane z atomem i mogą odrywać się od niego podczas tworzenia wiązań chemicznych. Powłoka ta może przyjmować też dodatkowe elektrony, a ich energia wiązania ma kluczowe znaczenie przy powstawaniu związków chemicznych. Elektrony niżej leżące rzadziej uczestniczą w reakcjach chemicznych.
W obrębie jednego okresu powłoka walencyjna jest zajmowana przez kolejne elektrony. Po zapełnieniu całej powłoki następuje przejście do nowego okresu i powstanie kolejnej powłoki elektronowej.
Można więc powiedzieć, że atomy występujące w tych samych okresach mają taką samą liczbę powłok elektronowych, a występujące w tych samych grupach mają taką samą liczbę elektronów na powłokach walencyjnych.
Wygląd współczesnego układu okresowego[edytuj | edytuj kod]
Współczesny wygląd układu okresowego zawdzięczamy Nielsowi Bohrowi, który podzielił go na grupy i okresy. Grupy zazwyczaj wypisuje się w kolumnach, a okresy w rzędach. Grupy dzieli się na grupy główne (1, 2, 13–18) i grupy poboczne (3–12). W grupach głównych okresy występują co osiem kolejnych atomów, co wynika z faktu, że na powłokach elektronowych od drugiej do czwartej mieści się dokładnie 8 elektronów. W grupach pobocznych sprawy mocno się komplikują, gdyż kolejne powłoki elektronowe mają coraz więcej miejsca dla elektronów. W grupach głównych wszystkie elektrony z powłoki walencyjnej zajmują orbitale typu: s i p, w grupach pobocznych orbitale: s i d, a w grupie lantanowców i aktynowców orbitale: s, d i f. Jest to podstawą do podzielenia układu okresowego na bloki: s i p (grupy główne), d (grupy poboczne) oraz f (lantanowce i aktynowce).
W większości współczesnych, graficznych przedstawień układu okresowego grupy główne są rozdzielone za drugą grupą całym blokiem d, a blok f jest „wyciągnięty” pod połączone bloki s, p i d.
| Grupa → d. ACS d. IUPAC |
1 IA IA |
2 IIA IIA |
3 IIIB IIIA |
4 IVB IVA |
5 VB VA |
6 VIB VIA |
7 VIIB VIIA |
8 VIII VIII |
9 VIII VIII |
10 VIII VIII |
11 IB IB |
12 IIB IIB |
13 IIIA IIIB |
14 IVA IVB |
15 VA VB |
16 VIA VIB |
17 VIIA VIIB |
18 0 0 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ Okres | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
* |
71 Lu |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | |
| 7 | 87 Fr |
88 Ra |
** |
103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | |
| * Lantanowce | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb | ||||||
| ** Aktynowce | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No | ||||||
| ||||||||||||||||||||
|
| |||||||||||||||||||
Układ okresowy a właściwości chemiczne atomów[edytuj | edytuj kod]

Współczesny układ okresowy (z rozdzielonymi blokami s, p, d i f) jest dobrym sposobem na przedstawienie zależności właściwości chemicznych od miejsca w układzie.
Pierwsze dwie grupy główne oprócz wodoru obejmują atomy o bardzo silnych właściwościach metalicznych, natomiast trzy przedostatnie (15–17) zawierają atomy o mniej lub bardziej wyraźnych właściwościach niemetalicznych. Wreszcie grupa 18 to gazy szlachetne.
Przechodząc w obrębie jednej grupy w dół (w kierunku coraz wyższej liczby atomowej) następuje we wszystkich grupach wzrost właściwości metalicznych, co w obrębie grup 13–17 przejawia się także spadkiem typowych właściwości niemetalicznych.
Stąd „najbardziej metaliczny” jest pierwiastek występujący na samym dole grupy 1 – frans, a „najbardziej niemetaliczny” jest atom na samej górze grupy 17 – fluor.
Wszystkie atomy grup pobocznych, a także lantanowce i aktynowce, to typowe metale. Ich właściwości również wykazują podobieństwa w obrębie tych samych grup, ale są to już bardziej subtelne cechy niż proste rozdzielenie na właściwości metaliczne i niemetaliczne.
Historia powstania układu okresowego[edytuj | edytuj kod]
Oryginalny układ okresowy został stworzony bez żadnej znajomości wewnętrznej struktury atomów, nie miał więc teoretycznego uzasadnienia.
Prawdopodobnie pierwszą osobą, która zauważyła, że pierwiastki ułożone według rosnących mas atomowych (pojęcie liczby atomowej nie było wówczas znane) wykazują pewną regularność właściwości, był niemiecki chemik Johann Wolfgang Döbereiner, który w 1817 roku zestawił grupy składające się z trzech pierwiastków o podobnych właściwościach chemicznych i cyklicznie wzrastających masach atomowych.
W roku 1863 francuski geolog Alexandre-Émile Béguyer de Chancourtois opublikował tzw. „bęben pierwiastków” (inaczej „śrubę telluryczną”; łac. tellus – ziemia). Narysował on na bębnie spiralnie wznoszący się łańcuch nazw pierwiastków. Średnica bębna była tak dobrana, że łańcuch tworzył pełny obrót spirali co osiem pierwiastków. Dzięki temu, patrząc wzdłuż linii prostopadłych do podstawy bębna na jego powierzchni bocznej widziało się zawsze pierwiastki o podobnych właściwościach chemicznych. Jego pomysł nie zdobył szerszej popularności.
Większy odzew uzyskało opublikowanie przez Johna Newlandsa jasno sformułowanego prawa okresowości w 1864 roku. Newlands stwierdził, że jeśli utworzyć listę pierwiastków według wzrastających mas atomowych (od wodoru do wapnia,) to ich właściwości powtarzają się w cyklu co osiem pierwiastków. Nazwał to prawem oktawy, na zasadzie skojarzenia z oktawami muzycznymi.

Za twórcę układu okresowego uważa się powszechnie Rosjanina Dmitrija Mendelejewa. Uczony ten próbował ułożyć pierwiastki w tabele, oparte na porządkowaniu ich w oparciu o ich masy atomowe. 6 marca 1869 roku[5] opublikował pierwszy układ okresowy, w którym zebrane już było ponad 90 pierwiastków.
Przełomowym pomysłem Mendelejewa było pozostawienie pustych miejsc tam, gdzie występowały duże różnice między masami atomowymi znanych ówcześnie pierwiastków i jednocześnie zakłócona była regularność ich właściwości chemicznych. Tak skonstruowany układ okresowy zdobył większe zainteresowanie ze strony innych chemików, gdyż umożliwiał przewidywanie masy atomowej i właściwości jeszcze nie odkrytych pierwiastków. Mendelejew przewidział istnienie 8 pierwiastków, z których trzy odkryto jeszcze za jego życia (german, gal i skand) i miały one taką masę atomową i właściwości, jak wynikało to z jego układu okresowego[6].
Mendelejew, układając układ okresowy, nie posiadał żadnej wiedzy na temat kwantowej budowy materii, a w szczególności zakazu Pauliego, który stanowi dla układu okresowego i chemii jako takiej podstawowe prawo fizyczne. Tablica pierwiastków została zestawiona przez niego wyłącznie na podstawie znajomości właściwości fizykochemicznych materii. Wkrótce okazało się, że konstrukcja ta nie tylko dostarcza dogodnego sposobu patrzenia na pierwiastki chemiczne, ale także pozwala na przewidywanie istnienia nowych pierwiastków.
Julius Lothar Meyer stworzył bardzo podobny układ pierwiastków, jednak nie wpadł na pomysł pozostawienia w nim pustych miejsc i stąd jego układ zawierał błędy w kilku miejscach. Układ ten został opublikowany w 1864 roku jako pomoc mnemotechniczna dla studentów chemii, nie docierając do szerszego grona odbiorców. W 1869 roku Meyer sporządził bardziej rozbudowany układ okresowy, zawierający wszystkie znane mu pierwiastki. Meyer, obawiając się komentarzy środowiska chemicznego, zwlekał z publikacją. Ostatecznie namówili go do niej bliscy współpracownicy. W trakcie jej pisania ukazała się jednak publikacja Mendelejewa, więc Meyer nie posłał swojej do druku.
Aż do początków XX wieku większość chemików miała do układu okresowego stosunek ambiwalentny, ponieważ nie znano racjonalnego uzasadnienia prawa okresowości. Pod koniec życia, zwłaszcza po sporze wokół masy atomowej telluru, nawet sam Mendelejew zwątpił w swoje odkrycie. Tellur, wbrew prawu okresowości, posiada bowiem wyższą masę atomową niż jod, choć ze względu na właściwości powinien mieć niższą (dziś wiadomo, że wynika to z naturalnego składu izotopowego obu pierwiastków). Ponadto w układzie okresowym Mendelejewa brak było miejsca na gazy szlachetne (krypton, ksenon i neon), które odkryto w latach 90. XIX wieku. Problem ten rozwiązał jednak odkrywca wspominanych gazów – William Ramsay, który dodał do układu grupę „0”[7].
Dopiero odkrycie jądra atomu przez Ernesta Rutherforda w 1911 roku i opublikowanie w 1913 roku przez jego ucznia, Henry’ego Moseleya, tabeli liczby protonów, neutronów i elektronów w kolejnych pierwiastkach oraz zaproponowanie koncepcji orbit i sfer elektronowych przez Bohra, a szczególnie sformułowanie zakazu Pauliego dało układowi okresowemu logiczne uzasadnienie oraz wyjaśniło pochodzenie właściwości chemicznych pierwiastków.
Graficzne sposoby przedstawiania układu[edytuj | edytuj kod]

Oprócz dwóch najczęściej stosowanych form układ okresowego (krótkiej i wydłużonej), wymyślono wiele różnych sposób jego przedstawiania. Już w 1908 roku Paul Walden w biografii Mendelejewa Berichte der Deutschen Chemischen Gesellschaft doniósł, że zostało opublikowanych ponad sto różnych grafik, ilustrujących układ okresowy[8]. Alternatywne formy powstały głównie w celach dydaktycznych, aby zaakcentować związki pomiędzy właściwościami chemicznymi lub fizycznymi pierwiastków, które nie są widoczne w postaci standardowej[9].
- tablica Mendelejewa – oryginalna tablica Mendelejewa była w zasadzie prostą tabelą z listą pierwiastków według wzrastającej masy atomowej i przypisaniem do określonego okresu; czasami przez tablicę Mendelejewa rozumie się tzw. krótką formę układu okresowego, która została prawdopodobnie sporządzona we współczesnej wersji po raz pierwszy przez Ramsaya;
- tablica Wernera – wprowadzona przez Alfreda Wernera w 1905 roku jest długą formą układu, z wydzielonymi blokami s, p i d; sam Werner stworzył ją, aby wyraźniej rozdzielić grupy główne i poboczne, nie mając świadomości, że podzielił pierwiastki na bloki uzasadnione kształtem ich orbitali walencyjnych;
- układ Bohra – współczesny wygląd układu okresowego w oparciu o tablicę Wernera; tym razem Bohr nieświadomie podzielił układ według elektroujemności pierwiastków, co wykorzystał Linus Pauling;
- tabela rozciągnięta, z wydzielonym blokiem f, zasugerowana przez Glenna T. Seaborga w 1969 roku, uwzględniająca koncepcje Nielsa Bohra i Jörgena Thomsena[10];
- tabela spiralna z 1960 roku, opracowana przez Theodora Benfeya[11] – nawiązująca nieco do układu De Chancourtois;
- tabela dla fizyków, zaproponowana przez Timmothy’ego Stowe’a; trójwymiarowa grafika, w której trzy osie reprezentują odpowiednio główną liczbę kwantową n, poboczną liczbę kwantową l oraz magnetyczną liczbę kwantową m;
- tabela w formie trójkąta, opracowana przez Emila Zmaczyńskiego i Thomasa Bayley’a[12];
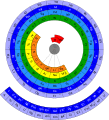
- Galaktyka chemiczna – eliptyczna spirala, której autorem jest Philip J. Steward, będąca najnowszą wersją postaci spiralnej układu okresowego, znanej chemikom żyjącym jeszcze przed Mendelejewem, zainspirowana grafiką namalowaną przez artystę Edgara Longmana w 1951 roku; według autora tego konceptu „łączy pierwiastki chemiczne z drogami gwiezdnymi w celach zilustrowania powiązań chemii z budową Wszechświata, pobudzenia wyobraźni i wskrzeszenia podziwu dla naturalnego porządku, który jest obecny w otaczającym człowieka Wszechświecie”[13];
- tabela wymyślona po raz drugi w 1970 roku przez młodego studenta Alberta Tarantolę, aktualnie profesora Sorbony, lecz oficjalnie opublikowana wiele lat później; klasyfikuje pierwiastki chemiczne w oparciu o poziomy energetyczne atomów, pozwalając na bezpośrednie odczytanie konfiguracji elektronowej; pierwszym jej pomysłodawcą był Charles Janet w 1929[14];
- tabela dla homeopatów standardowa i spiralna[15].

W sztuce i publikacjach[edytuj | edytuj kod]
Edward G. Mazurs w książce Graphical Representations of the Periodic System During One Hundred Years podał wiele historycznych szczegółów, związanych z układem okresowym[16].
Przed wejściem do Wydziału Technologii Chemii i Żywności Politechniki w Bratysławie znajduje się pomnik, przedstawiający Mendelejewa oraz układ okresowy.
Na stronie zwanej potocznie zoo układów okresowych[17] można obejrzeć ponad 50 różnych postaci graficznych układów okresowych, od najstarszych, opracowanych przez samego Mendelejewa, do najnowszych, a także tablicę w języku chińskim oraz układ okresowy w formie słonia.
Galeria różnych form układu okresowego[edytuj | edytuj kod]
-
Postać spiralna Benfeya
-
Postać dla fizyków Stowe’a
-
Postać trójkątna Zmaczyńskiego i Bayleya
-
Postać Tarantoli
-
Postać rozszerzona
-
Postać pętli Hyde’a
-
Postać Alexandra
-
Postać piramidalna
-
Postać standardowa dla homeopatów
-
Postać spiralna dla homeopatów
-
Postać okrągła Mohda Abubakra z Indii
-
Postać „ADOMAH”
Zobacz też[edytuj | edytuj kod]
- Lista pierwiastków chemicznych
- Nazewnictwo pierwiastków chemicznych
- Rozszerzony układ okresowy pierwiastków
- Klasyfikacja lantanowców i aktynowców
- Homeopatyczny układ okresowy pierwiastków
Przypisy[edytuj | edytuj kod]
- ↑ Pierwiastków chemicznych układ okresowy, [w:] Encyklopedia PWN [dostęp 2021-07-30].
- ↑ Periodic Table of the Elements. IUPAC. [dostęp 2016-12-01].
- ↑ IUPAC – International Union of Pure and Applied Chemistry: Discovery and Assignment of Elements with Atomic Numbers 113, 115, 117 and 118 [online], www.iupac.org [dostęp 2016-01-03] [zarchiwizowane z adresu 2015-12-31].
- ↑ Elements 113, 115, 117, and 118 are now formally named nihonium (Nh), moscovium (Mc), tennessine (Ts), and oganesson (Og). IUPAC, 2016-11-30. [dostęp 2016-12-01].
- ↑ Układ okresowy pierwiastków, czyli chemia w tabeli - Kulinarny czwartek - polskieradio.pl [online], www.polskieradio.pl [dostęp 2019-05-09].
- ↑ Historia Układu Mendelejewa na stronie Uniwersytetu Opolskiego. uni.opole.pl. [zarchiwizowane z tego adresu (2009-04-11)]..
- ↑ Scerri, E. R. (2006) The Periodic Table: Its Story and Its Significance; New York City, New York; Oxford University Press.
- ↑ Review: Persistent Pursuit of the Periodic System.
- ↑ Alternative periodic tables. chemeurope.com. [zarchiwizowane z tego adresu (2008-01-07)]..
- ↑ Extended Periodic Table of the Elements. jeries.rihani.com. [zarchiwizowane z tego adresu (2008-12-24)]..
- ↑ Teaching and Research Web Site. dwb.unl.edu. [zarchiwizowane z tego adresu (2007-12-15)]..
- ↑ Presentation forms of the periodic table.
- ↑ Chemical Galaxy.
- ↑ Strona osobista A. Tarantoli.
- ↑ Jan Scholten, Roger Savage, Secret Lanthanides, Utrecht: Stichting Alonnissos, 2005, ISBN 90-74817-16-5, OCLC 71658673.
- ↑ Mazurs, E. G. Graphical Representations of the Periodic System During One Hundred Years. Alabama; University of Alabama Press, 1974. ISBN 0-8173-3200-6.
- ↑ strona zoo układów okresowych.
Linki zewnętrzne[edytuj | edytuj kod]
- Michael Dayah: Dynamiczny Układ Okresowy.
- Mark Winter: WebElements Periodic Table. (ang.).
| Układ okresowy pierwiastków | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3[i] | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||||
| 8 | Uue | Ubn | ✱ | |||||||||||||||||||||||||||||||||||||||||
| ✱ | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | ...[ii] | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||